پس از گذر از عصر ابزار های سنگی،انسان به استفاده از فلزات به علت ویژگی های منحصر به فرد آن ها پرداخت.فلزاتی مانند مس،آهن،نقره و پس از آن آلومینیوم و روی مورد استفاده وسیع در صنایع مختلف قرار گرفت.اما مشکل بزرگ این مواد نیز ناپایداری آن ها به صورت خالص و تمایل آن ها برای تبدیل شدن به ترکیباتی مانند اکسید فلزی بود که موجب نابودی فلز می شد.در این زمان بود که لزوم وجود علمی به نام علم خوردگی (Corrosion) و بررسی دلایل ایجاد این پدیده ناخواسته و روش های جلوگیری از آن مورد توجه قرار گرفت.خوردگی فلزات به شکل ها و دلایل مختلف به وجود می آید ولی مهمترین دلیل به وجود آمدن آن را می توان در واکنش های الکتروشیمیایی در فلزات بررسی کرد.
مطابق استاندارد 8044ISO ، خوردگی فلز بدین شکل تعریف میشود:
«واکنش فیزیکی – شیمیایی متقابل بین فلز و محیط اطرافش که معمولا دارای طبیعت الکتروشیمیایی است و نتیجهاش تغییر در خواص فلز میباشد. این تغییرات خواص ممکن است منجر به از دست رفتن عملکرد فلز ، محیط یا دستگاهی شود که این دو ، قسمتی از آن را تشکیل میدهند. »
همچنین موسسه ملی مهندسی خوردگی آمریکا (NACE) تعریف زیر را از خوردگی در کتاب مرجع خوردگی NACE آورده است:
«…زوال یک ماده (معمولا فلز) یا خواص آن بر اثر واکنش با محیط اطراف»
لغت خوردگی به طور ویژه برای فرآیند فرسایش فلزات به کار می رود.لغت زنگ زدن (Rust) نیز که معمولا عموم مردم با آن روبرو شده اند به خوردگی فلز آن مربوط است.
برای مطالعه بیشتر درباره خوردگی کلیک کنید.
- مضرات اقتصادی خوردگی
گرچه فرآیند خورده شدن فلز همواره جنبه زیان آور ندارد،مثلا تولید برق در باطری در اثر واکنش الکتروشیمیایی آند و کاتد با الکترولیت است و یا فرآیند مهم آبکاری (Electroplating) با استفاده از همین خاصیت فلز انجام می پذیرد ،لیکن در این بحث به جنبه های مضر و مخرب خوردگی فولاد و جلوگیری از آن در صنایع دریایی می پردازیم.
امروزه تمامی سازه های ساختمانی و صنعتی با استفاده از فلزات و به خصوص فولاد ساخته می شود.آسیب های ناشی از خوردگی علاوه بر زیان های اقتصادی می تواند خطرات جانی فراوانی را نیز به همراه داشته باشد.روش های حفاظتی فلزات نیز هر ساله با هزینه های گزاف انجام می شود ولی با نگاهی به برخی آمارها[1] می توان از این هزینه ها نسبت به هزینه ای سرسام آور ناشی از خسارات خوردگی چشم پوشی کرد.بر اساس تحقیقاتی که در سال های 1999 تا 2000 در ایالات متحده آمریکا صورت گرفت ،خسارات مستقیم ناشی از خوردگی رقمی حدود 276 میلیارد دلار در سال برآورد شد.بزرگی این رقم زمانی معلوم می شود که این عدد را با تولید ناخالص ملی آمریکا مقایسه شود.بر این اساس این هزینه معادل 3.1% کل تولید ناخالص ملی آمریکا است که 137.9 میلیارد دلار از این رقم تنها به بخش صنعت اختصاص دارد.در ایران نیز بررسی های غیر رسمی در این مورد صورت گرفت.بر اساس این تحقیقات، زیان های مستقیم ناشی از خوردگی در سال 1373 حدود 5000 میلیارد ریال، در سال 1375 حدود 9000 میلیارد ریال و در سال 1379حدود 27500 میلیارد ریال برآورد شده است.
- مکانیسم خوردگی
خوردگی را می توان از دیدگاه های مختلف بررسی کرد.که هر یک اطلاعات خاصی را به دست می دهد.مهمترین جنبه ای که برای خوردگی در نظر گرفته می شود خاصیت الکتروشیمیایی آن است.اما برخی دیگر از ویژگی های این فرآیند با پدیده های ترمودینامیکی ، سینتیکی و شیمیایی قابل توجیه است.
- بررسی فرآیند خوردگی از دیدگاه الکتروشیمیایی
الکتروشیمی علم بررسی واکنش هایی است که در آن الکترون بین مواد جابجا می شود،به عبارتی عدد اکسایش مواد طی واکنش های اکسایش و کاهش دچار تغییر می شود.
واکنش های الکتروشیمیایی از دو نیم واکنش فرضی به نام های واکنش اکسایش و واکنش های کاهش یا احیا تشکیل شده است.در واکنش کاهش یا احیا ،یون فلزی با گرفتن الکترون به شکل فلز خالص در می آید.این واکنش در تشکیل یک لایه فلزی بر روی سطوح رسانا و در آبکاری کارایی دارد.
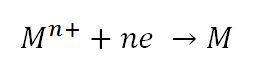
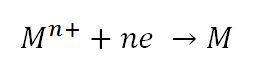
در آند نیز برعکس،یعنی فلز به صورت خالص با از دست دادن الکترون به یون فلزی تبدیل می شود.
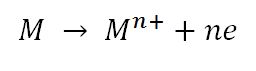
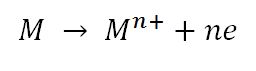
تبادل این الکترون ها می تواند موجب آزاد شدن انرژی به صورت جریان الکتریسیته شود.که اساس تولید باطری ها و پیل های شیمیایی است.
اگر از فلزات مختلف در ساخت یک پیل شیمیایی استفاده شود.فلز فعال تر آند واقع شده و اکسید می شود و فلز نجیب تر(کمتر فعال) کاتد واقع شده و احیا می شود.در نتیجه می توان با مقایسه این نیم واکنش ها نسبت به یک نیم واکنش مرجع ،انرژی تولید شده از هر نیم واکنش را به دست آورد که در فهم بهتر عملکرد یک پیل شیمیایی به ما کمک می کند.
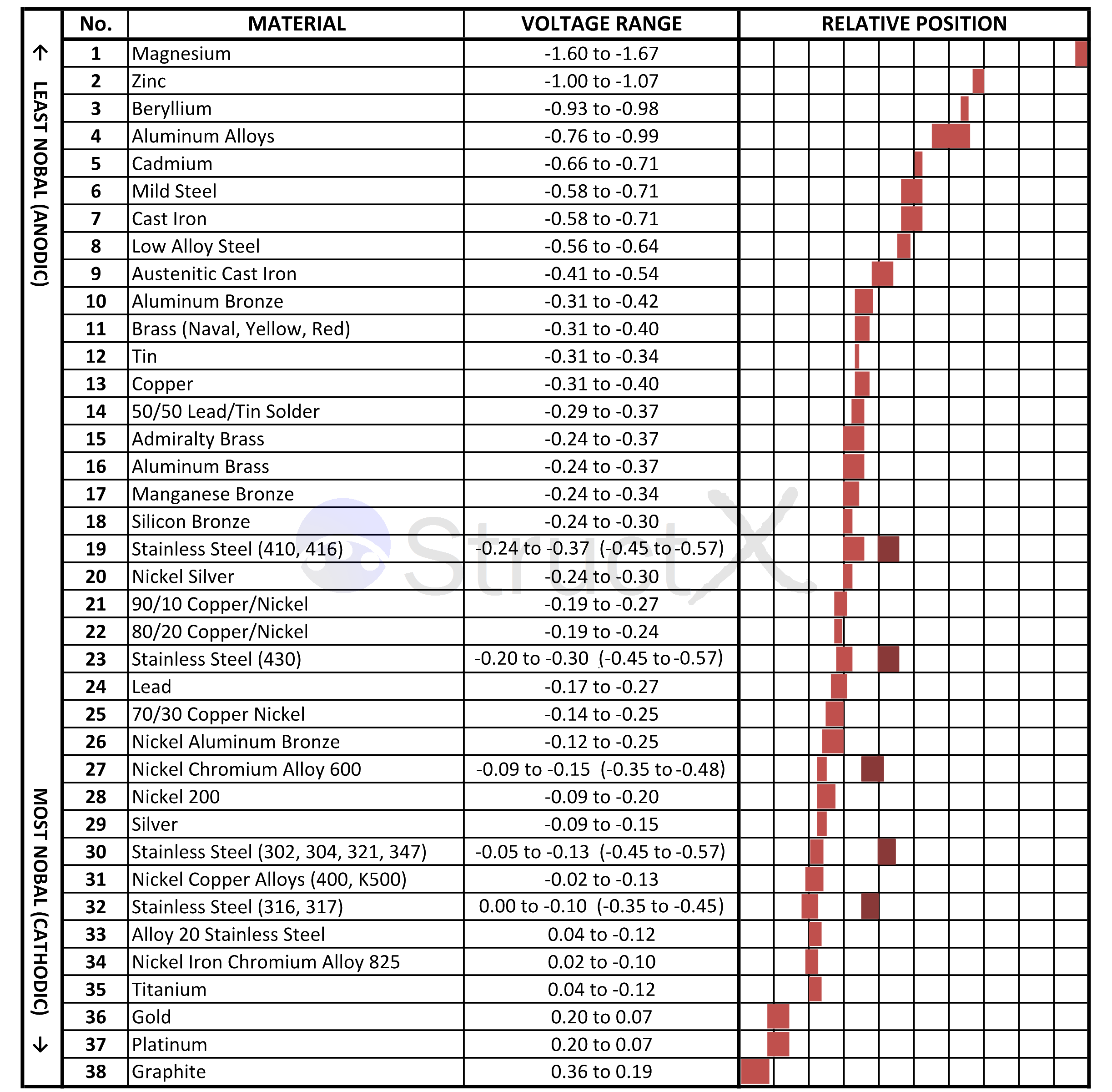
به طور قرار دادی واکنش احیای هیدروژن (SHE[6]) را به عنوان نیم واکنش مرجع در نظر می گیریم و نیروی محرکه الکتریکی ([7]emf) آن صفر فرض می شود.نیروی محرکه الکتریکی عبارت است از جریان الکتریکی تولیدی در یک سلول ولتایی که با واحد ولت گزارش می شود.نیروی محرکه بیشتر ،بیانگر تمایل بیشتر آن نیم پیل یا سلول برای انجام واکنش است.با انجام آزمایشات متعدد و مرتب کردن نتایج آن بر حسب مقدار عددی نیروی محرکه الکتریکی،جدولی به دست می آید که جدول پتانسیل کاهشی معروف است.در جدول زیر این مقدار برای فلزات مختلف نشان داده شده است:(داده ای جدول در دمای 25 درجه سانتی گراد می باشد.)


فلز هایی که در بالای جدول قرار دارند (فلزات بالای هیدروژن) نسبت به فلزات پایین تر (فلزات زیر هیدروژن) تمایل بیشتری به واکنش دارند.در نتیجه بر این اساس می توان جدول ساده تری به دست آورد که در آن فلزات بر حسب تمایلشان به خوردگی و به صورت مقایسه ای مرتب شده اند.این جدول که به سری گالوانیک[8] یا سری الکتروپتانسیل[9] معروف است،معیار خوبی برای مقایسه فلزات از نظر خوردگی است به این ترتیب که اگر دو فلز کنار هم قرار بگیرند،فلزی که در سری گالوانیک بالاتر است،نسبت به فلز پایین تر زود تر خورده می شود.این قانون اساس طراحی سیستم های حفاظت کاتدی می باشد.

- بررسی فرآیند خوردگی از دیدگاه ترمودینامیکی
ترمودینامیک علم بررسی امکان وجود یا عدم امکان وجود واکنش بین مواد است.از نظر ترمودینامیکی همه مواد و سیستم ها تمایل دارند به پایدار ترین شکل خود که در آن سطح انرژی مواد پایین باشد برسند.توجیه علم ترمودینامیک برای پدیده خوردگی به این صورت است که فلزات در حالت سنگ معدن به صورت ترکیب با عناصر مختلف قرار دارند.در این شرایط فلز پایدار است و در پایین ترین سطح انرژی قرار دارد.با استخراج فلز از سنگ معدن آن،مقداری انرژی صرف می شود و فلز موجود در سنگ که به صورت یون قرار دارد با دادن الکترون احیا می شود.در نتیجه فلز در این حالت به خاطر صرف انرژی برای استخراج و دادن الکترون های اضافی به آن ،به یک حالت ناپایدار با سطح انرژی بالا می رسند.در این شرایط فلز دائما در پی فرصتیست تا با از دست دادن الکترون های اضافی به سطح انرژی پایین تر و شرایط پایدار تر برسند.و همانطور که از نظر الکتروشیمیایی بررسی شد فلز در واکنش اکسایش به این هدف می رسد که همان خورده شدن فلز است.پس می توان گفت که پدیده خوردگی جرئی از طبیعت و ماهیت فلزات است،مانند ریزش آب از آبشار که تمایل طبیعی اجسام به جذب شدن در میدان گرانش است و اگر بخواهیم بر خلاف جهت میدان حرکت کنیم نیاز به صرف انرژی داریم.در فرآیند خوردگی صرف این انرژی همان روش های حفاظتی و پوشش های اعمال شده بر سطح فلز است.
- بررسی فرآیند خوردگی از دیدگاه سینتیکی
علم سینتیک شیمیایی[10] به بررسی مکانیسم انجام واکنش ها و سرعت پیشرفت یک واکنش در شرایط محتلف می پردازد.گاه پیش می آید که یک واکنش از نظر ترمودینامیکی انجام پذیر است اما مشاهدات چیز دیگری را نشان می دهد.پیش بینی ترمودینامیک فاقد ایراد یا خطا بوده ولی باید به این نکته توجه داشت که ترمودینامیک صرفا شدنی بودن واکنش را بیان می کند.حال ممکن است این واکنش در کسری از ثانیه رخ دهد یا سال ها به طول انجامد.در اینجا لزوم دخالت دادن فاکتور زمان در محاسبات خوردگی معلوم می شود.سرعت یک واکنش معیار مناسبی است که میزان پیشرفت یک واکنش با زمان را بیان می کند.سرعت خوردگی معمولا برحسب میل[11] در سال (mpy) بیان می شود و طبق رابطه زیر محاسبه می شود:
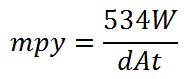
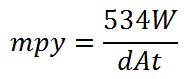
در این رابطه نشان دهنده تقلیل وزن بر حسب میلی گرم (mg)، دانسیته نمونه بر حسب گرم بر سانتی متر مکعب ()، سطح نمونه بر حسب اینچ مربع () و زمان آزمایش بر حسب ساعت (hr) می باشد.
واحد میل بر سال عمدتا در آمریکا مورد استفاده می باشد اما می توان با چند تبدیل واحد ساده،معادل این واحد را در سیستم های دیگر مانند SI به دست آورد.
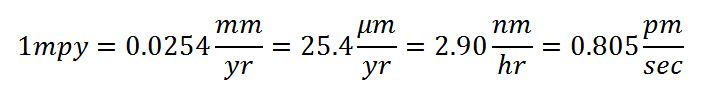
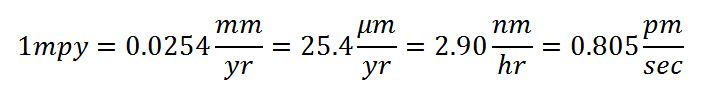
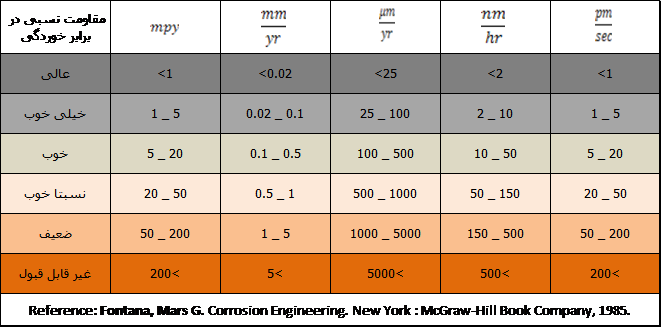
با توجه به جدول زیر می توان از طریق مقدار عددی به دست آمده برای این کمین در واحد های مختلف،به طور مقایسه ای میزان مقاومت به خوردگی را بررسی کرد.

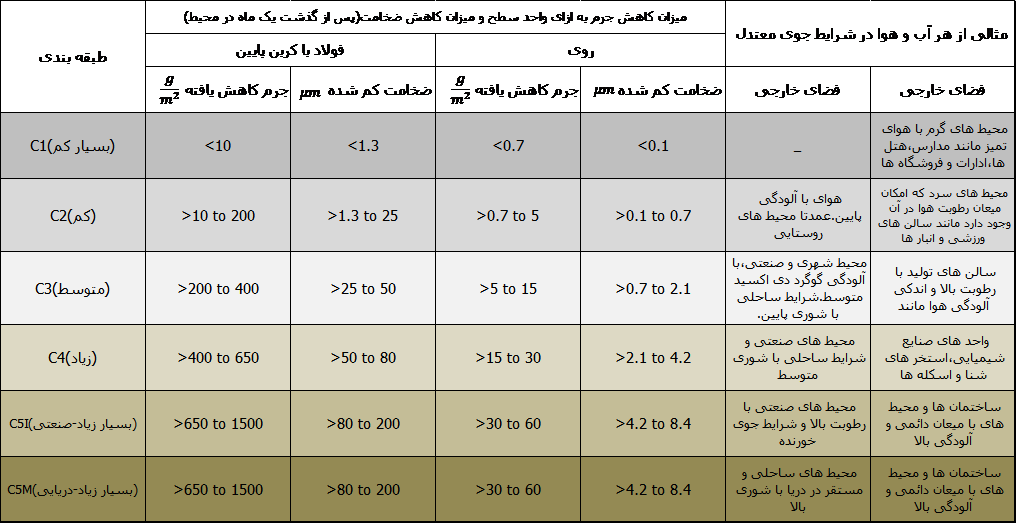
همچنین بر اساس استاندارد ایزو ISO12944 می توان میزان سرعت خوردگی را در شرایط مختلف با کدهای C1 تا C5M نمایش داد که به ترتیب نشان دهنده کمترین سرعن خوردگی و بیشترین سرعت خوردگی می باشد.در جدول زیر میزان خوردگی برای هر کد نشان داده شده از و چند نمونه برای هر یک ذکر شده است.

- بررسی فرآیند خوردگی از دیدگاه شیمیایی
بر اساس تعاریف بنیادی که برای واکنش های شیمیایی و فیزیکی داریم،یعنی این که در واکنش شیمیایی ماهیت مواد تغییر می کند ولی در واکنش فیزیکی ماهیت ماده یا مواد ثابت می ماند،می توان فرآیند خوردگی را یک واکنش شیمیایی دانست.در این واکنش یک فلز و یک ماده شیمیایی فعال مانند یک اسید با هم واکنش داده و یک یا چند محصول تولید می کند که خواص آنها به طور قطع با مواد اولیه متفاوت است.به عنوان مثال فرآیند زنگ زدن آهن در حضور کلریدریک اسید به شکل زیر است:
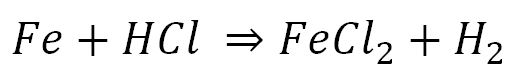
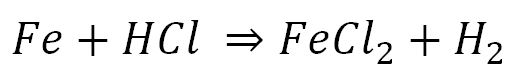
در این واکنش H2 و FeCl2 محصولات خوردگی هستند که H2 به صورت گاز وارد اتمسفر شده و FeCl2 بر روی فلز باقی می ماند.
به عنوان مثالی دیگر فرآیند خورده شدن آهن در اثر تماس با باران های اسیدی که از ترکیب شدن اکسیدهای گوگرد و کربن با آب به وجود می آیند ،به صورت زیر است:
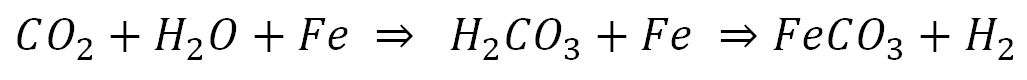
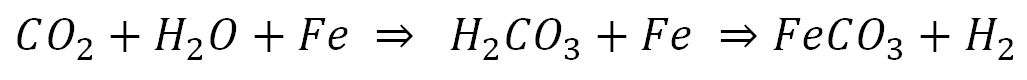
در این واکنش نیز نوعی از باران اسیدی که حاوی H2CO3 است در اثر تماس آب باران با CO2 به وجود می آید. این ماده اسیدی در تماس با بدنه فولاد آهن را به صورت ترکیب در آورده که به صورت باقی مانده محصولات خوردگی بر روی سطح فولاد می چسبد.این نوع از خوردگی در مناطق صنعتی و شهرهای بزرگ به دلیل تراکم بالای مواد آلاینده، بسیار شایع است.
همچون دیگر واکنش های شیمیایی،برخی واکنش ها بین فلز و مواد خورنده ،کند تر انجام شده و برخی دیگر به شدت تمایل به واکنش دارند.همچنین همانند بسیاری از دیگر واکنش های شیمیایی در این واکنش ها نیز گرمای ناشی از واکنش مواد ،انجام پذیر بودن یا نبودن و موازنه مواد واکنش دهنده و فرآورده، قابل بحث است .
- خوردگی در فولاد
خوردگی در فولاد به واسطه وجود دو عامل اصلی یعنی رطوبت و اکسیژن هوا رخ می دهد که طبعا عدم وجود هر یک از این عوامل از خورده شدن فولاد جلوگیری می کند.در حین فرآیند خوردگی بر روی بدنه فولاد،برخی نواحی نقش آند و برخی دیگر نقش کاتد را ایفا می کنند.البته این نواحی بسیار کوچک و نزدیک به هم هستند و نمی توان آن را به طور واضح روی سطح زنگ زده مشخص کرد.در آند اتم های آهن با از دست دادن الکترون به یون آهن تبدیل می شوند:
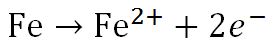
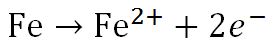
در کاتد برای جذب و مصرف شدن الکترون های اضافی ،مولکول های آب و اکسیژن با دریافت الکترون به یون هیدروکسید تبدیل می شوند:
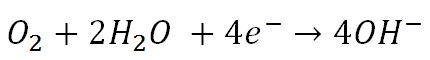
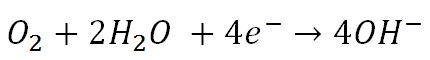
این واکنش اهمیت وجود اکسیژن و آب را به صورت همزمان برای ایجاد خوردگی در آهن نشان می دهد.چرا که در صورت نبود هر یک از این دو عامل نیم واکنش کاتدی صورت نمی پذیرد و در نتیجه واکنش خوردگی ناقص می ماند و متوقف می شود.
پس از تولید شدن یون در آند و در کاتد،هر دو یون به داخل محلول الکترولیت نفوذ کرده و هیدروکسید آهن (II) را ایجاد می کند:
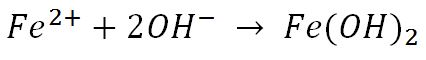
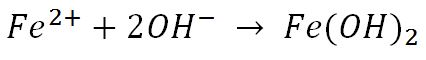
در حضور مقدار اضافی از اکسیژن در محیط اطراف،واکنش اکسایش یک مرحله دیگر به پیش می رود:
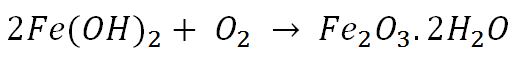
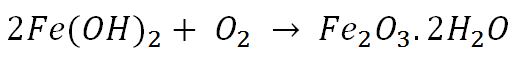
محصول این واکنش یعنی همان زنگ زدگی شناخته شده آهن است که رنگی قهوه ای و متمایل به قرمز دارد.
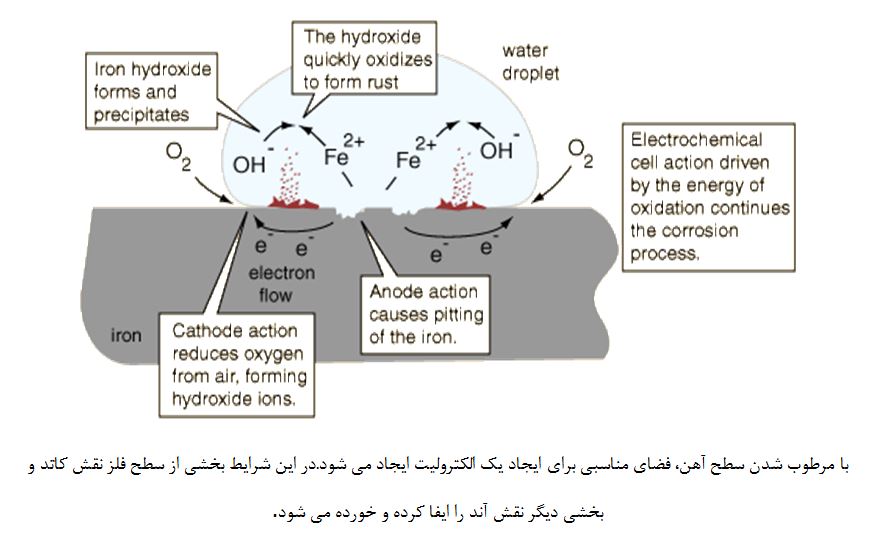
در شکل زیر شمایی کلی از فرآیند زنگ زدگی آهن و واکنش های صورت گرفته در آند و کاتد نشان داده شده است.








ثبت ديدگاه