خوردگی در فلزات یک واکنش شیمیایی و الکتروشیمایی است که طی آن فلز دچار تخریب و تغییر در خواص خود می شود.فلزات امروزه به دلیل خواص فیزیکی در بسیاری از صنایع من جمله صنایع دریایی کاربرد فراوان دارند و اکثر سازههای دریایی و کشتیها از فلزات و آلیاژهای مختلف ساخته شدهاند.از اینرو جلوگیری از تخریب و خوردگی آنها بسیار با اهمیت می باشد.
هنگامی که دو فلز مختلف(با پتانسیل الکتروشیمیایی مختلف) و یا فلز با یک محلول الکترولیت در تماس باشد، طی واکنشهای الکتروشیمیایی فلز با پتانسیل کمتر(آند)دچار خوردگی خواهد شد و فلز دیگر با پتانسیل بیشتر(کاتد) محافظت میگردد. دراین صورت آند فدا شده و کاتد مصون میماند(حفاظت کاتدی).در فرایند خوردگی جریان الکترونها از آند به سمت کاتد و جریان یونها در محلول الکترولیت برقرار میگردد.واکنش آندی الکترون را آزاد کرده و واکنشهای کاتدی الکترونهای آزاد شده را مصرف می کنند. واکنشهای کاتدی بسته به نوع محیط و مواد موجود در آن متفاوت است.


به طور کلی پدیده خوردگی از سه منظر مورد مطالعه قرار میگیرد:
- واکنشهای الکتروشیمیایی (اکسایش و کاهش)
- ترمودینامیک (خود به خودی یا غیر خود به خودی بودن واکنشها)
- سینتیک (سرعت انجام خوردگی)
در فرایند خوردگی، ترمودینامیک اساساً به بررسی امکان انجام واکنشهای کاتدی و آندی میپردازد و اطلاعاتی راجع به سرعت خوردگی نخواهد داد. هنگامی که دو فلز در تماس با هم قرار میگیرند برای اینکه بفهمیم فرآیند خوردگی انجام میپذیرد یا خیر، و همچنین پیبردن به اینکه کدامیک ازفلزها آند و کدامیک کاتد است، از جدول پتانسیل شیمیایی آنها استفاده میکنیم.این جدول(emf) پتانسیل شیمیایی فلزات را نسبت به پتانسیل شیمیایی استاندارد هیدروژن (SHE) بررسی میکند.
E standard Hydrogen Electrode (SHE) = 0
همانطور که گفته شد ترمودینامیک در خوردگی به انجام پذیری یا انجام ناپذیری فرآیند خوردگی یا به عبارت دیگر،خود به خودی یا غیر خود به خودی بودن واکنش میپردازد.برای روشنتر شدن موضوع یک سل الکتروشیمیایی را در نظر بگیرید.
انواع سل الکتروشیمیایی
سل خود به خودی
هنگامی که یک قطعه فلز مس در تماس با محلول الکترولیت خود (CuSo4 ) و فلز روی در تماس با محلول الکترولیت خود قرار میگیرد و این دو فلز توسط یک سیم به هم وصل شده و دو محلول الکترولیت نیز به وسیله یک پل نمکی با هم در ارتباط باشند شکلی شماتیک ، به صورت زیر خواهیم داشت:
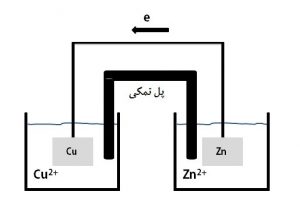

E Cu/Cu 2+ = +0.34 v (SHE) E Zn/Zn 2+ = – 0.76 v (SHE)
در این حالت جریان الکترونها در سیم از سمت آند (فلز با پتانسیل کمتر) به سمت کاتد (فلز با پتانسیل بیشتر) برقرار میگردد.
لازم به ذکر است که فرآیند خوردگی در فلزات هنگامی که در تماس با محیط خورنده (مثلا آب دریا) قرار دارند خود به خودی است، چون تغییرات انرژی آزاد گیبس برای آن منفی می شود.
سل غیر خود به خودی
در این نوع از سلها نیاز به مصرف انرژی داریم.این نوع از سلها در آبکاری فلزات (پوشش یک فلز توسط فلز دیگر) کاربرد دارد.تغییرات انرژی پتانسیل برای سل غیرخودبهخودی منفی و تغییرات انرژی آزاد گیبس برای آن مثبت است.
برای یک سل الکتروشیمیایی چه چیزهایی لازم است؟
- آند
- کاتد
- اتصال سیم که انتقال الکترونها را مهیا میکند.
- الکترولیت که انتقال یونها را مهیا میکند.
برای انجام خوردگی تمامی این 4 مورد میبایست همزمان وجود داشته باشند در غیر اینصورت خوردگی رخ نخواهد داد.پس میتوان نتیجه گرفت جهت جلوگیری از خوردگی فلزات ضروریست در حداقل یکی از این موارد اخلال ایجاد نمود.
مقابله با خوردگی به وسیله پوشش ها


برای مقابله با خوردگی توسط پوشش ها سه مکانیزم اصلی زیر وجود دارد:
-
مانع شوندگی (Barrier Protection)
این مکانیزم در پوششهای سالم و بدون نقص به وسیله جلوگیری در انتقال مواد،یون ها و… از سطح زیرآیند به محیط و برعکس صورت میپذیرد.چنانچه مقاومت در برابر نفوذ عوامل خورنده شامل اکسیژن آب و رطوبت ، یونهای الکترولیت(مانند So42- ) و … افزایش یابد،خوردگی کمتری خواهیم داشت(مانند پوششهای غنی از روی).
-
حفاظت کاتدی(آند فداشونده)
اگر پتانسیل مادهای که پوشش داده میشود از پتانسیل مواد به کار درفته در پوشش بیشتر باشد در این حالت ماده زیرآیند کاتد خواهد شد و از آن محافظت میگردد و آند خورده میشود. یک پوشش زینک ریچ از این مکانیزم هم تبعیت میکند.
-
حفاظت از طریق غیرفعال کردن(حفاظت آندی)(Passivation )
هنگامی که فلز در تماس با محیط هوا قرار میگیرد یک لایه اکسیدی بر روی آن به وجود میآید. چنانچه بتوانیم این لایه اکسیدی را حفظ کنیم فرآیند خوردگی با خلل روبرو خواهد شد.

-
مواد بازدارنده خوردگی
این مواد بسته به نوع فلز و محیط خورنده متفاوت هستند.به طور کلی این مواد به سه دسته زیر تقسیم میشوند:
- بازدارنده آندی( به وسیله جلوگیری از آزاد شدن یونها در سطح فلز مانند فسفاتها)
- بازدارنده کاتدی(جلوگیری از نفود یونهای کاتیونی چون Mg2+ )
- بازدارنده مخلوط(ترکیب بازدارندههای کاتدی چون Zn2+ و آندی مانند فسفاتها)
انواع خوردگی
خوردگی یکنواخت
در این نوع خوردگی واکنشهای شیمیایی بهطور یکنواخت در سطح فلزات با جابجایی پیوسته آند و کاتد رخ میدهد.این نوع خوردگی اغلب در تمام فلزات دیده میشود.
خوردگی گالوانیکی
هر گاه دو فلز غیر هم جنس در یک الکترولیت تشکیل یک پیل خوردگی دهند، خوردگی گالوانیکی حاصل میشود. علت ایجاد این نوع خوردگی در بین فلزات را میتوان به اختلاف پتانسیل الکتروشیمیایی آنها نسبت داد. پتانسیل دو فلز در الکترولیتهای مختلف نسبت به یکدیگر متفاوت است.
خوردگی حفرهای
که به صورت موضعی این نوع خوردگی در حفرات سطح فلز اتفاق میافتد. ناخالصیهای غیر فلزی، ناهمگنیهای ساختاری و شیمیایی در سطح فلز نقاط متداول مناسبی برای آغاز این نوع خوردگی و شروع ایجاد حفره است.
خوردگی شکافی
نوعی از خوردگی الکتروشیمیایی موضعی است که در شکافها اتفاق میافتد.مکانیزم خوردگی شکافی تا حدود زیادی مشابه با مکانیزم خوردگی حفرهای است.این نوع خوردگی بیشتر میتواند در زیر واشرها، میخ پرچها، پینها به وجود آید.
خوردگی تنشی
خوردگی تنشی نتیجه تأثیر همزمان تنشهای مکانیکی محیط خورنده مناسب بر روی فلز است. این تنشهای مکانیکی میتواند ناشی از تنشهای خارجی یا داخلی باشد.برای مثال عملیات حرارتی یک نوع تنش خارجی می تواند باشد.
خوردگی سایشی
خوردگی در اثر سایش ناشی از حرکت سیال تشدید میشود.با افزایش مواد جامد در سیال این نوع خوردگی تشدید میشود.
خوردگی غلظتی
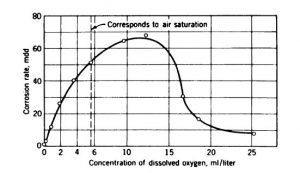
یکی از این انواع خوردگی،خوردگی براساس اختلاف غلظت اکسیژن است .در نواحی که غلظت اکسیژن زیاد یا کم است آند و کاتد تشکیل شده و خوردگی غلظتی شروع خواهد شد.


عوامل موثر بر خوردگی
- درجه خلوص(هر چه فلز خالصتر باشد،دیرتر خورده می شود)
- تنشهای مکانیکی و فیزیکی فلز
- غلظت اکسیژن موجود
- درجه حرارت
- اسیدی یا قلیایی بودن محیط







ثبت ديدگاه